فروش مواد شیمیایی تصفیه آب و فاضلاب
فروش مواد شیمیایی مورد استفاده در تصفیه آب و تصفیه فاضلاب در هایپر صنعت فامکو
کاتالوگ معرفی مواد شیمیایی فامکو
مواد شیمیایی تصفیه آب

از دیرباز تاکنون، کمبود منابع آب آشامیدنی سالم و بهداشتی به عنوان یکی از مهم ترین چالش های جوامع بشری مطرح بوده است. لذا اهمیت تصفیه آب بر کسی پوشیده نیست. از سوی دیگر، تصفیه آب نیاز اجتناب ناپذیر صنایع مختلف نیز می باشد و در چهار شاخه اصلی (تصفیه آب بویلرها، تصفیه آب سیستم خنک کننده، خالص سازی آب و تصفیه پساب های صنعتی)، از اهمیت ویژه ای برخوردار است.
دیونیزه شدن/ آب تصفیه شده
تعاریف و استاندارهای واضح برای آب مقطر، آب معدنی و آب یونیزه شده کاملا متفاوت است. احتمالا ساده ترین و قدیمی ترین و بهترین روش شناخته شده برای تولید آب با کیفیت بالا، تقطیر است.
آب مقطر، آبی است که در دستگاهی به نام استیل جوشیده می شود و سپس در یک واحد خنک کننده (مبرد) مجددا احیاء شده تا آب به حالت مایع بازگردد. تقطیر برای آب تصفیه شده استفاده می شود. آلاینده های حل شده مانند نمک ها در دیگ بخار می روند و سپس به عنوان بخار آب بیرون می آیند. اگر آلاینده ها، فرار (قابل تبخیر) باشند، ممکن است این کار نیز انجام نشود. بنابراین آن ها اغلب می جوشند و غلیظ می شوند مانند برخی از محلول ها که دارای الکل هستند. دستگاه تقطیر خیلی دقیق می تواند (مایع شدن) آب از سایر مواد فرار را انتخاب کند، اما بیشتر فرایندهای تقطیر اجازه می دهد تا حداقل برخی از مواد فرار را منتقل کنند و مواد غیر فرار بسیار کمی که به حباب های بخار آب منتقل می شوند مانند ترکیدن حباب روی سطح آب جوش. حداکثر خلوص دستگاه معمولا MΩ.cm 1.0 است که به تقطیر تبدیل می شود، به طور کلی pH محلول بین 4.5 تا 5 است. علاوه بر این، باید توجه داشت که مجددا پس از تقطیر آب، آلودگی ایجاد نشود.
دیونیزه کردن
دیونیزاسیون فرایندی است که با استفاده از رزین های تبادل یونی خاص، نمک های یونی را از آب حذف می کند. از لحاظ نظری 100٪ می توان نمک را حذف کرد. دی یونیزه کردن، معمولا نوعی حذف کردن یون های آلی است که ویروس و باکتری ها را حذف نمی کند مگر اینکه از طریق تصادفی در دامنه رزین و به ویژه رزین های آنیونی پایدار ساخته شود که باکتری های گرم منفی را حذف کند. یکی دیگر از فرآیندهای احتمالی برای تولید آب دیونیزه شده، الکترو دیونیزه کننده است.
حذف مواد معدنی
فرآیندی که برای حذف مواد معدنی از آب استفاده می شود، فرایند تبادل یونی است.
آب با خلوص بالا
آب با خلوص بالا، آبی است که دارای مقاومت بالا و بدون مواد آلی می باشد و معمولا در صنایع نیمه هادی و داروسازی استفاده می شود.
دیونیزاسیون مستلزم حذف مواد منحل شده الکتریکی (یونیزه شده) محلول با اتصال آن ها به نقاط مثبت یا منفی بر روی یک رزین است زیرا آب از طریق یک ستون پر شده با این رزین عبور می کند. این فرآیند تبادل یون نامیده می شود و می تواند به روش های مختلف برای تولید آب دیونیزه شده با کیفیت های مختلف استفاده شود.
- سیستم های رزین اسید کاتیونی قوی + بازی آنیونی قوی
این سیستم شامل دو لوله است:
- رزین کاتیونی تبادل یون در فرم (+H)
- رزین آنیونی در فرم هیدروکسیل (-OH)
آب از طریق ستون کاتیونی جریان می یابد و در نتیجه تمام کاتیون ها با یون های هیدروژنی مبادله می شوند. سپس آب تصفیه شده از طریق ستون آنیون جریان می یابد. در این زمان، تمام یون های بار منفی به یون های هیدروکسید منتقل می شوند که سپس با یون های هیدروژن ترکیب می شوند تا آب (H2O) را تشکیل دهند. این سیستم ها تمام یون ها را از جمله سیلیس حذف می کنند. در اکثر موارد توصیه می شود که شار یون هایی که به مبدل آنیون منتقل می شوند، با نصب واحد حذفی CO2 بین لوله های تبادل یونی، کاهش یابد. این باعث کاهش مقدار CO2 به مقدار میلی گرم بر لیتر می شود و باعث کاهش حجم رزین پایه آنیونی قوی و نیاز به واکنش احیاء می شود. به طور کلی سیستم رزین های اسید کاتیونی قوی و باز آنیونی قوی، ساده ترین تصفیه است و آب دیونیزه شده که ممکن است در طیف وسیعی از کاربردها مورد استفاده قرار گیرد.
- سیستم های رزین اسید کاتیونی قوی + باز آنیونی ضعیف + باز آنیونی قوی
این ترکیب حاصل از ترکیبات قبلی است:
این سیستم همان کیفیت آب دیونیزه را فراهم می کند، برای آب هایی که حاوی مقادیر زیادی آنیون های قوی (کلرید و سولفات) هستند، مزایای اقتصادی زیادی را در بر دارد. سیستم مجهز به مبدل اضافی باز آنیونی ضعیف قبل از آخرین مبدل باز آنیونی قوی است. حذف انتخابی واحد CO2 ممکن است پس از مبدل کاتیونی یا بین دو مبدل آنیونی نصب شود. احیاء مبدل های آنیونی با محلول سود سوز آور در ابتدا از طریق رزین بازی قوی و سپس از طریق رزین بازی ضعیف صورت می گیرد. این روش مستلزم کمبود سدیم هیدروکسید نسبت به روش پیشنهادی است که قبل از آن به کار رفته است، زیرا محلول احیاء شده پس از مبدل باز آنیونی قوی باقی مانده معمولا برای احیای کامل رزین بازی کافی است. علاوه بر این، هنگامی که آب خام دارای مقدار زیادی مواد آلی است، رزین بازی ضعیف از رزین بازی قوی محافظت می کند.
- مخلوط بستر دیونیزه شده
در بستر مخلوط، رزین های تبادل کاتیونی و آنیونی کاملا مخلوط شده و در یک مخزن تحت فشار قرار می گیرند. دو رزین به وسیله مخلوط کن با هوای فشرده مخلوط می شوند، به همین ترتیب بستر را به عنوان تعداد بی شماری از مبدل های آنیونی و کاتیونی در سری (رزین مخلوط) می توان در نظر گرفت.
برای انجام بازسازی، دو رزین در طول فاز خم شدن از نظر هیدرولیکی جدا می شوند. همانطور که رزین آنیونی سبک تر از رزین کاتیونی است، به بالای آن می رسد، در حالی که رزین کاتیونی به پایین می افتد. بعد از مرحله جداسازی، احیاء با سود سوزآور و یک اسید قوی انجام می شود. مزایای استفاده از سیستم های مخلوط به شرح زیر است:
- آب با خلوص بسیار بالا به دست آمده و کیفیت آن در طول چرخه ثابت باقی می ماند.
- pH تقریبا خنثی است.
- الزامات آب شست و شو بسیار کم است.
معایب سیستم های مخلوط بسته به ظرفیت تبادل پایین و روش عملیاتی پیچیده ای است که به دلیل جدا سازی و برداشتن مراحل باید انجام شود.
در کنار سیستم های تبادل یون، آب دیونیزه می تواند توسط اسمز معکوس تولید شود. اسمز معکوس بهترین فیلتراسیون شناخته شده است. این فرآیند اجازه خواهد داد که ذرات هم اندازه ی یون های یک محلول را حذف کنیم. اسمز معکوس برای تصفیه آب و حذف نمک ها و سایر ناخالصی ها به منظور بهبود رنگ، طعم و خواص آب استفاده می شود. اسمز معکوس قادر به رد کردن باکتری ها، نمک ها، قندها، پروتئین ها، ذرات، رنگ ها و سایر اجزاء است که وزن مولکولی آن ها بیش از 150-250 دالتون است. اسمز معکوس می تواند اکثر استانداردهای آب را با یک سیستم عبور و بالاترین استانداردها را با یک سیستم دوبار عبور مواجه کند. این روند باعث رد شدن 99.9٪ + از ویروس ها، باکتری ها و پیروژن ها می شود. فشار در محدوده 50 تا 1000 پاسکال، نیروی محرکه فرآیند تصفیه RO است. این نسبت به فرایندهای تغییر فاز (تقطیر) بسیار کارآمدتر از مواد شیمیایی قوی مورد نیاز برای بازسازی تبادل یون می باشد. جداسازی یون ها با اسمز معکوس توسط ذرات باردار انجام می شود، به این معنی که یون های حل شده دارای بار مانند نمک ها احتمال بیشتری در عبور از غشا نسبت به یون های آلی دارند. بار بزرگتر و ذرات بزرگتر، احتمال عبور بیشتری از غشا دارند.
اندازه گیری خلوص
خلوص آب می تواند به روش های مختلف اندازه گیری شود. اولین روش می تواند برای تعیین وزن تمام مواد حل شده، انجام شود. شاخص اندازه گیری مواد نیز تحت تأثیر محلول در آب قرار می گیرد. به همین ترتیب، خلوص آب می تواند به سرعت بر اساس هدایت الکتریکی و یا مقاومت اندازه گیری شود. آب بسیار خالص الکتریسیته بسیار کمی را هدایت می کند، بنابراین مقاومت آن بالا است.
مقدار pH
آب خالص بر اساس تعریف، کمی اسیدی است و آب مقطر حدود pH 5.8 را آزمایش می کند. علت این است که آب مقطر دی اکسید کربن هوا را حل می کند. این دی اکسید کربن تا زمانی که در تعادل پویش با اتمسفر باشد، حل می شود. به این معنی که مقدار حل شده، با مقداری که از محلول خارج می شود، تعادل دارد. مقدار کل در آب با غلظت در جو تعیین می شود. دی اکسید کربن حل شده با آب واکنش می دهد و در نهایت اسید کربنیک را تشکیل می دهد.
آب بدون املاح
آب بدون املاح یا آب معدنی، آبی است که از مواد معدنی یا نمک حذف می شود. در کاربردهایی که در آن آب حاوی مقدار کمی نمک یا رسانایی کم مورد نیاز است، استفاده می شود، مانند:
- آب خوراک بویلر
- برنامه های دارویی
- صنعت الکترونیک
- کاربردهای خوراکی
- کاربردهای صنعتی
برای هر کاربرد از هدایت مورد نیاز استفاده می شود. با وجود تعادل اسید-باز آب، هدایت الکتریکی همواره باقی می ماند. آب معدنی با بهترین کیفیت دارای مقاومت حدودی 18.2 مگا اهم بر سانتی متر یا هدایت 0.055 میکروزیمنس بر سانتی متر است. آب دیونیزه می تواند از طریق تبادل یون با رزین های کاتیونی و آنیونی تولید شود. رزین ها باید با اسید و سود کاستیک احیاء شوند. برای کاهش هزینه های احیاء برای سیستم های بزرگتر، آب با واکنش اسمز معکوس از مواد معدنی بیرون می رود، که میزان کل نمک را با بیش از 90 درصد کاهش می دهد و به همین ترتیب هزینه های احیاء کاهش می یابد. پس از مبدل های کاتیونی و آنیونی، مبدل های یون های مخلوط شده برای کاهش هدایت حتی بیشتر استفاده می شوند. امکان فرآیند دیگری برای ایجاد آب معدنی، دیونیزه کردن الکتریکی است. در بیشتر موارد اسمز معکوس بیش از 99.8 درصد نمک ها را حذف می کند و این کافی است. کاربردهای معمول برای آب معدنی استفاده از آب با خلوص بالا است که استانداردهای بالاتری برای آلودگی آب دارد. در این مورد مواد آلی همراه با اجزای بیولوژیکی حذف می شوند. آب خالص با بهترین کیفیت در صنعت میکروتراشه و داروسازی استفاده می شود.
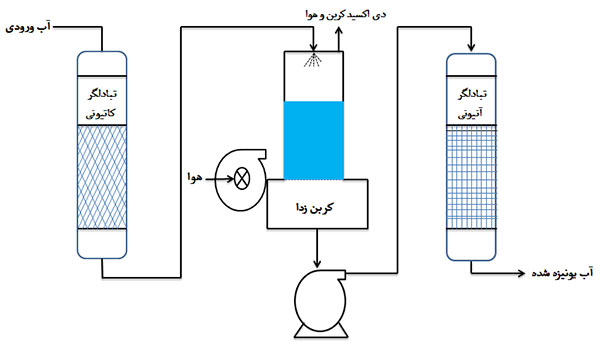
هر چند تصفیه آب و فاضلاب همواره به عنوان یک فرآیند هزینه بر از سوی صاحبان صنایع مطرح بوده است، اما فواید آن در دراز مدت بر کاهش هزینه های نگهداری و افزایش طول عمر تجهیزات از یک سو و حفاظت از محیط زیست، از سوی دیگر به خوبی تائید شده است.
تصفیه آب آشامیدنی
چه موادی هست که املاح آب را ته نشین می کنند؟ آلایش منابع آب آشامیدنی به انواع آلودگی های شیمیایی و میکروبی، به خوبی بیانگر اهمیت تصفیه آب برای تامین آب قابل شرب می باشد. تصفیه آب، فرآیندی برای حذف آلودگی ها یا کدورت (ذرات جامد معلق، باکتری ها، خزه ها، ویروس ها، قارچ ها، و غیره) از منابع آب است، که به تولید آب آشامیدنی سالم برای انسان می انجامد. حذف آلودگی ها از آب شامل سه فرآیند فیزیکی (ته نشینی و فیلتراسیون و غیره)، شیمیایی (گندزدایی، لخته گذاری و غیره) و بیولوژیکی است.
مهمترین پارامتر در تشخیص میزان کیفیت آب کدورت می باشد. یکی از عواملی که سبب ایجاد کدورت در آب می شود حذف ذرات کلوئیدی توسط انجام فرآیندی به نام انعقاد یا لخته سازی است به همین دلیل از مواد منعقد کننده که دارای ویژگی هایی همچون ناپایداری ذرات و چسباندن آن ها بهم هستند، در جهت رفع کدورت یا آلودگی استفاده می شود انواع منعقد کننده به طور معمول شامل اکسید کننده ها، عوامل جاذب و سنگین، سیلیکات فعال، پلی الکترولیت می باشند.
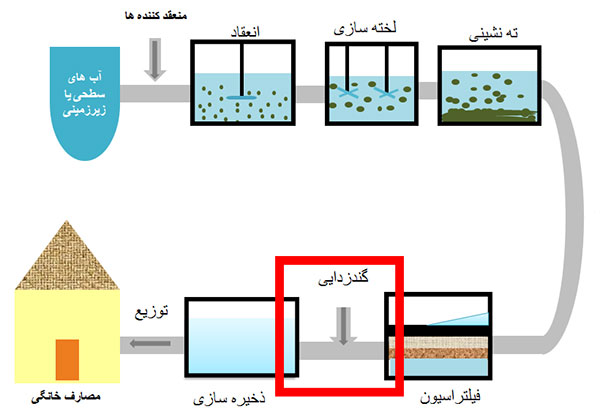
برخی از مواد شیمیایی که در تصفیه آب مورد استفاده قرار گرفته می شوند شامل موارد زیر می باشند:
پلی آکریل آمید (پلی الکترولیت یا فلوکولانت)
این ماده شیمیایی با نام اختصاری PAM به عنوان یک عامل کمک منعقد کننده و برای از بین بردن ناخالصی های معلق و کلوئیدی در آب کاربرد دارد. این ماده به عنوان عامل تصفیه کننده عوامل کدورت رنگ، طعم و بوی ناخوشایند در آب بوده و موجب افزایش سرعت ته نشینی ذرات کلوئیدی در فرآیند تصفیه آب و فاضلاب می شود.
پلی آلومینیوم کلراید (PAC)
یکی از مواد شیمیایی منعقد کننده پرکاربرد در صنعت تصفیه آب می باشد که موجب کاهش لجن شیمیایی می شود. بدین ترتیب یک فاکتور مهم در مدیریت پسماند حاصل از تصفیه آب محسوب شده که نهایتا موجب ایجاد آب شفاف تر می شود.
آلومینیوم سولفات
این ماده با نام دیگر آلوم یا زاج سفید به عنوان عامل لخته ساز، ذرات و ناخالصی های معلق در آب را جذب کرده و ته نشین می کند. در نهایت موجب کاهش کدورت آب و مواد فعال سطحی در طی فرآیند تصفیه آب و فاضلاب می شود.
سولفات آهن
این ماده به عنوان یکی از مهم ترین عوامل کاهش دهنده مواد فعال سطحی در آب و همچنین به دلیل دارا بودن یون های آهن، توانایی حذف کردن عوامل سختی آب مثل یون های کلسیم و منیزیم می شود.
کلر
به عنوان یک عامل ضد عفونی کننده بسیار مهم در صنعت تصفیه آب و فاضلاب برای گندزدایی، ضد عفونی و از بین بردن عوامل بیماری زا کاربرد دارد.
آنتی فوم
به منظور از بین بردن کف حاصل از فرآیندهای مختلف در طی تصفیه آب و فاضلاب شامل فرآیند لجن فعال و حوضچه های هوادهی کاربرد دارد. بدین ترتیب از کاهش راندمان تصفیه جلوگیری می کند و مانع ایجاد مشکلات و صرف هزینه های بسیار می شود.
نیتریت سدیم
به عنوان عامل ضد باکتری برای جلوگیری از رشد باکتری ها و کنترل بو در صنعت تصفیه فاضلاب کاربرد دارد.
بیکربنات سدیم
این ماده که با نام جوش شیرین نیز شناخته می شود، برای کنترل pH و به عنوان ضد عفونی کننده ضعیف استفاده می شود.
ضد رسوب یا آنتی اسکالانت
از این مواد در طی فرآیند تصفیه آب و برای سیستم های آب شیرین کن RO استفاده می کنند. با این توضیح که مانع ایجاد رسوب املاح و نمک های معدنی آب ورودی بر روی ممبران های صنعتی می شود. بدین ترتیب از پوسته پوسته شدن غشا سیستم تصفیه آب اسمز معکوس RO پیشگیری می شود.
بایوساید
به عنوان عامل کنترل کننده فعالیت میکروارگانیسم ها و به صورت کلی برای ضد عفونی و ازبین بردن باکتری ها، جلبک ها، قارچ ها و کپک ها کاربرد دارد.
ژل میکروسیلیس
این ماده یکی از مهم ترین مواد شیمیایی کاربردی در سازه های بتنی مورد استفاده در تصفیه خانه های آب و فاضلاب می باشد. با این توضیح که از طریق پر کردن منافذ موجود در بتن موجب نفوذناپذیری، ایجاد مقاومت بالا و آب بندی در آنها می شود.
زداینده اکسیژن
این مواد از طریق واکنش با اکسیژن محلول در آب، موجب حذف آن و ممانعت از خوردگی شده یا تاثیرات آن را کاهش می دهند.
دیسپرس کننده
این مواد که با نام پخش کننده نیز شناخته می شوند، از طریق نفوذ به لخته های تشکیل شده (فلاک)، موجب جداسازی ذرات تشکیل دهنده آنها شده و به بهبود فرآیند های ته نشینی و تصفیه آب و فاضلاب کمک می کنند.
آهک هیدراته
این ترکیب شیمیایی با نام هیدروکسید کلسیم نیز شناخته شده و به عنوان یک فلوکولانت یا کمک منعقد کننده برای ایجاد ذرات سنگین تر و سرعت ته نشینی بیشتر، در تصفیه آب و فاضلاب کاربرد دارد.
آلومینات سدیم یا بتا آلومینا
به عنوان یک ماده رسوب دهنده قوی و جزو مواد شیمیایی مورد استفاده در صنایع آب و فاضلاب با عنوان منعقد کننده یا کواگولانت ها کاربرد دارد.
کلروفریک یا کلرید آهن
این گروه از ترکیبات منعقد کننده برای رفع کدورت آب، رفع بوی نامطبوع و همچنین کنترل رنگ استفاده می شوند.
سدیم متا بی سولفیت
به منظور حذف کلر در آب و کلرزدایی، از این ترکیب شیمیایی استفاده می کنند.
مواد ضد بو
این ترکیبات به عنوان از بین برنده بوی نامطبوع فاضلاب و کنترل کننده بو کاربرد دارند.
مونو کلرو آمین
این ماده به عنوان یک نوع ضد عفونی کننده و برای بهبود طعم و بوی آب آشامیدنی استفاده می شود.
دی اکسید کلر
این ماده به عنوان ضد عفونی کننده اصلی در آب های سطحی که دارای طعم و بوی ناخوشایند هستند، محسوب می شود. اساس عملکرد این مواد نفوذ به دیواره سلولی باکتری ها و نابودی آنها می باشد. کلریت محصول جانبی حاصل از این واکنش می باشد.
سدیم هیدروکسید و سود پرک
به عنوان تنظیم کننده و تثبیت کننده pH آب کاربرد دارند. از آن جایی که این مواد خاصیت قلیایی دارند، بنابراین با افزایش pH آب، برای حذف فلزات سنگین محلول در آب و کاهش خوردگی استفاده می شوند.
ازن
یک ماده شیمیایی ضد عفونی کننده و گندزدا برای آب های آشامیدنی محسوب می شود که ناپایدار بوده و قدرت اکسید کنندگی زیادی دارد. ازن نسبت به کلر قدرت گندزدایی بیشتری داشته و بر خلاف کلر برای انسان خطرزا نیست.
رزین ها
از رزین های کاتیونی و آنیونی در صنعت تصفیه آب و فاضلاب برای حذف ذرات معلق در آب و کاهش سختی به کمک فرآیند تبادل یونی استفاده می کنند.
سیلیس
این ماده با نام دیگر سیلیکا به عنوان بستر مخازن فیلتر شنی آب و فاضلاب برای از بین بردن ذرات معلق کاربرد دارد که نهایتا موجب زلال شدن آب می شود.
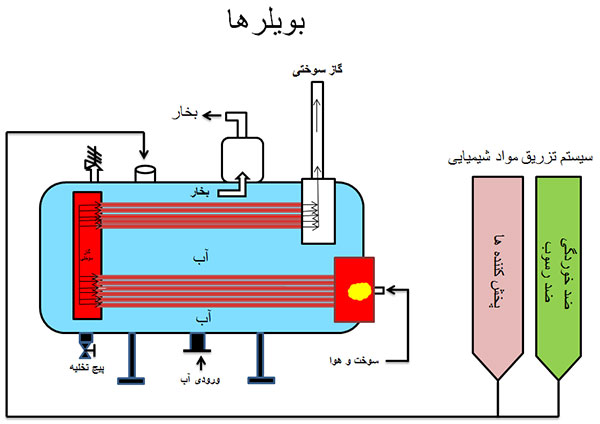
تصفیه آب بویلرها
خوردگی تدریجی در سیستم های آب تغذیه، سبب تولید یون های فلزی محلول و ذرات می شود که با ورود به بویلر یا دیگ بخار در دمای بالا رسوب می کنند. حتی بهترین برنامه های تصفیه آب نیز قادر نخواهند بود جلوی این پدیده را بگیرند. این رسوبات سرانجام سبب مسائلی از قبیل خوردگی زیر رسوبی و محدودیت در انتقال حرارت می شوند.
در اغلب بویلرها، حتی بویلر های دارای برنامه های پایش منظم نیز اکسید آهن، مس و اکسیدهای مس و مقادیر کمی از فلزات آلیاژی (نیکل، کروم و روی) در رسوبات دیده می شود. نشتی لوله های کندانسور و دیگر موارد سبب بالا رفتن دمای مجاز و خوردگی بیشتر می شود. به عنوان نمونه در یک مورد نشتی کندانسور، تشکیل رسوبات خرابی ها می تواند سبب افزایش تشکیل رسوبات شود. آلودگی های اصلی شامل نمک های حاصل از سختی و سیلیس آب است که حلالیت اغلب این مواد با افزایش دما کاهش می یابد.
این رسوبات بسیار مضر بوده و خوردگی زیر رسوبی سبب وارد شدن خسارت های هنگفت به لوله ها شد. در مورد دیگر نیز نشتی در کندانسورهای بزرگ سبب کاهش pH از 9.2 به 8.5 در کمتر از یک ساعت و تبدیل کلرید منیزیم به هیدروکسید منیزیم شد و کارکنان واحد به صورت مقطعی کندانسور را از خط خارج و آلودگی را تخلیه کرده و در اسرع وقت شست و شوی شیمیایی بویلر را انجام دادند.
از دیگر عوامل بسیار مهم در انتخاب حلال و فرایند شستشو، نوع لایه های رسوب گذاری شده است که متداول ترین آنها رسوبات اکسید آهن و مس می باشد. خرابی های گاه به گاه در سیستم شیمیایی آب ورودی، سبب خوردگی آلیاژهای مس در کندانسور و لوله های مبدل های حرارتی شده و باعث انتقال محصولات خوردگی به بویلر و دیگ می شود.
مواد مورد استفاده در بویلرها انواع مختلفی دارند که بسته به نوع مصرف مورد استفاده قرار می گیرند:
- زداینده های اکسیژن دیگ بخار
- مهارکننده های رسوبات و انباشته ها بویلرها
- بازدارنده میعانات خورنده بویلرها
- مواد ضد کف بویلرها یا آنتی فوم ها
- مواد تنظیم کننده PH بویلرها
- مواد از بین برنده گل و لای دیگ بخار
بروز مشکلات ناشی از تشکیل رسوب و خوردگی در سیستم های پالایشگاهی و نیروگاهی لزوم تصفیه آب بویلرها را به خوبی آشکار می سازد. فرآیند تصفیه آب در بویلرها، علاوه بر کاهش مصرف انرژی، بازده فرآیند و طول عمر این تجهیزات را بهبود می بخشد.
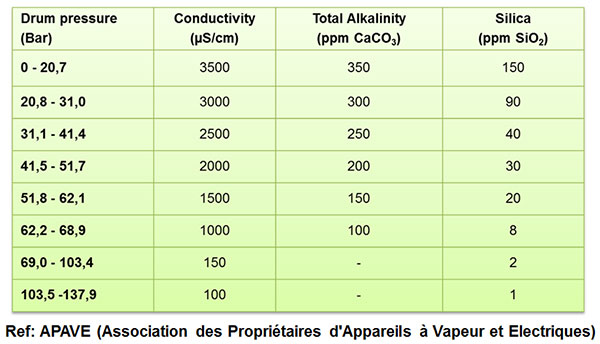
آب ورودی بویلر تا فشار 100 بار
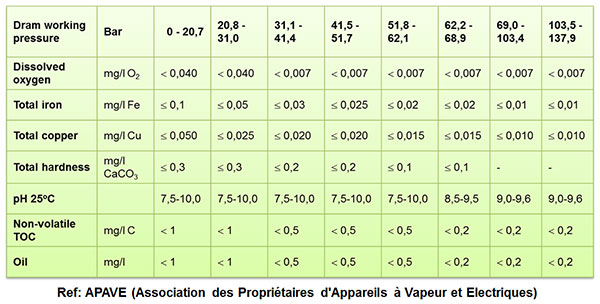
آب بویلر تا فشار 100 بار
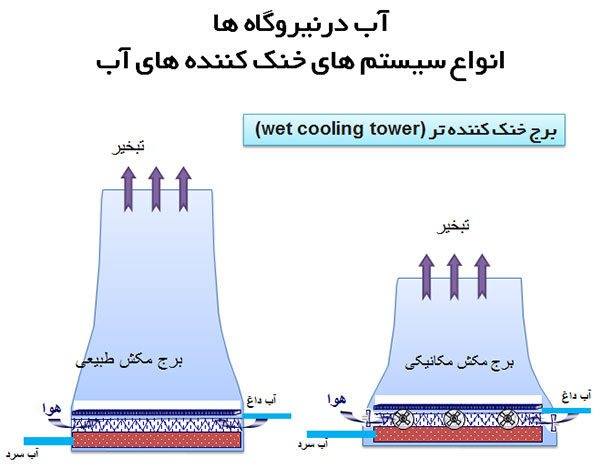
تصفیه آب سیستم های خنک کننده
تصفیه آب سیستم های خنک کننده نه تنها مانع از تشکیل رسوب و ایجاد خوردگی در این سیستم ها می شود، بلکه از بروز پدیده فولینگ که عامل ایجاد محیطی مناسب برای رشد و تکثیر باکتری های مضر است، جلوگیری به عمل می آورد. علاوه بر این، عدم تصفیه آب خنک کننده سبب کاهش بازده و طول عمر مفید نیروگاه ها می شود. آمارها به خوبی نشان می دهند که عدم تصفیه آب سیستم های خنک کننده، سالیانه بیش از 10 هزار دلار هزینه های اضافی ناشی از هدرفت انرژی، مواد شیمیایی و آب مصرفی، بر اقتصاد دنیا تحمیل می کند.
مواد شیمیایی تصفیه فاضلاب

امروزه تصفیه فاضلاب (خانگی و صنعتی)، به عنوان یکی از پارامترهای تعیین کننده توسعه پایدار جوامع بشری مطرح است، که نقش به سزایی در کاهش آلودگی های محیط زیست و جبران کمبود منابع آب مورد نیاز صنایع دارد.
در دنیای پیشرفته امروزی، رشد صنایع به موازات تامین آرامش و امنیت بشر، سبب بروز مشکلات متعددی از جمله مشکلات زیست محیطی برای جوامع شده است. یکی از مهم ترین مشکلات زیست محیطی که بشر با آن رو به روست، آلایش آب ها به مواد آلی معلق و قابل ته نشینی، انواع میکرو اُرگانیسم ها، فلزات سنگین، و سایر مواد جامد است، که به واسطه فعالیت های روزمره و صنعتی انسان رخ می دهد. اثرات مخرب ناشی از دفع نامناسب پساب های خانگی و صنعتی بر محیط زیست و سلامت انسان، لزوم تصفیه هر چه کامل تر فاضلاب ها را به خوبی روشن می سازد. از سوی دیگر کمبود منابع آب برای استفاده در صنعت، شاهدی بر لزوم حذف آلودگی ها از آب، برای استفاده مجدد در صنایع می باشد.
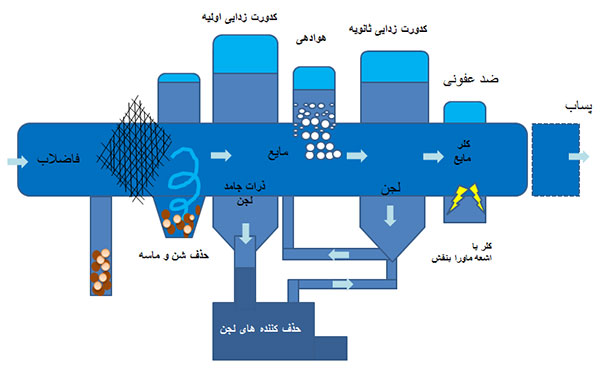
تصفیه فاضلاب در سه بخش مقدماتی (اولیه)، بیولوژیکی (ثانویه) و شیمیایی انجام می شود. تصفیه مقدماتی یک مرحله تصفیة فیزیکی (آشغال گیری، دانه گیری، شناورسازی یا فلوتاسیون، ته نشینی مواد معلق و یکنواخت کردن ترکیب شیمیایی و pH فاضلاب) است. تا کنون روش های بیولوژیکی گوناگون هوازی و غیر هوازی در تصفیه فاضلاب ها بکار گرفته شده اند، که هر یک از این روش ها از امتیازات و بعضا معایبی برخوردار هستند. تصفیه شیمیایی فاضلاب مبتنی بر استفاده از مواد شیمیایی مانند گندزداها، مواد منعقدکننده و لخته ساز، مواد جاذب سطحی، شناورسازها و غیره می باشد.
تصفیه فاضلاب
فرایند زدودن آلاینده ها از پساب، به ویژه فاضلاب خانگی است که شامل فرایندهای شیمیایی، فیزیکی و بیولوژیکی برای زدودن این آلاینده ها و تامین فاضلاب تصفیه شده که برای محیط زیست بی خطر است، می باشد. معمولا یکی از محصولات تصفیه فاضلاب، زباله نیمه جامد است که لجن فاضلاب نامیده می شود که نیازمند تصفیه جداگانه پیش از دفن یا استفاده است.
در برخی از کشورهای پیشرفته، یک تصفیه اولیه روی پساب صنعتی انجام می شود تا بار آلودگی آن را پیش از مخلوط شدن با فاضلاب خانگی کاهش دهد. این فرایند، تصفیه فاضلاب صنعتی نامیده می شود. پساب صنعتی ممکن است حاوی موادی باشد که با روش های معمول تصفیه، زدوده نشوند. همچنین یکنواخت نبودن جریان پساب صنعتی به دلیل چرخه های تولید، می تواند تنظیمات تصفیه بیولوژیکی از جمله فرایند لجن فعال را به هم بریزد.
جمع آوری و تصفیه فاضلاب، تابع استانداردها و قواعد محلی و کشوری است. تصفیه فاضلاب عموما از سه مرحله تشکیل می شود که تصفیه اولیه، ثانویه و ثالثه نامیده می شوند.
فرآیندهای پر کاربرد در تصفیه فاضلاب
لجن فعال متعارف
در این سیستم، فاضلاب، آشغالگیری و دانه گیری شده پس از عبور از واحد ته نشینی اولیه، وارد واحد هوادهی می شود و پس از آن به منظور جداسازی لخته های بیولوژیکی تشکیل شده، به واحد ته نشینی راه می یابد و بخشی از لجن ته نشین شده به منظور تامین بیومس سلولی در واحد هوادهی مجددا به این واحد برگشت داده می شود. این فرایند معمولاً برای فاضلاب های با قدرت کم استفاده می شود و زمان ماند در این سیستم ها معمولا کوتاه می باشد.
هوادهی گسترده
این فرآیند در حقیقت یکی از پرکاربردترین و موثرترین اصلاحات لجن فعال است که از ویژگی های بارز این سیستم زمان ماند طولانی و تثبیت نسبتا کامل جامدات آلی می باشد. در ابتدا این سیستم برای تصفیه جریان فاضلاب تولیدی جوامع کوچک مسکونی مورد استفاده قرار می گرفت. مدت زمان هوادهی در این سیستم بین ۱۸ تا ۳۶ ساعت می باشد و مقدار لجن حاصل از این فرایند نسبتا کم و از نظر کیفیت بیولوژیکی تثبیت شده تر نسبت به فرایندهای مشابه می باشد.
روش های تصفیه فاضلاب
- روش های فیزیکی
- روش های شیمیایی
- روش های بیولوژیکی
روش های فیزیکی شامل آشغالگیری، دانه گیری، فیلتراسیون و ته نشینی می باشد. روش شیمیایی شامل انعقاد و لخته سازی، تبادل یون و تنظیم pH می باشد. روش های شیمیایی نسبت به روش های فیزیکی پیچیده تر و هزینه بر بوده و همچنین از لحاظ هزینه خرید و نگهداری مواد شیمیایی و بهره برداری نیز مناسب نیستند. به همین دلایل سعی می شود حتی الامکان از این روش برای حذف آلاینده ها استفاده نشود. در فرآیند بیولوژیکی با توجه به کیفیت فاضلاب از یکی از روش های هوازی یا بی هوازی و یا هر دو استفاده می شود.
قیمت مواد شیمیایی تصفیه آب و فاضلاب
برای اطلاع از قیمت مواد تصفیه آب و فاضلاب می توانید به صفحه محصول مورد نظر مراجعه کنید یا با کارشناسان هایپر صنعت فامکو تماس بگیرید.














دیـــدگاهها
شما هم درباره این کالا دیدگاه ثبت کنید.
امتیاز: