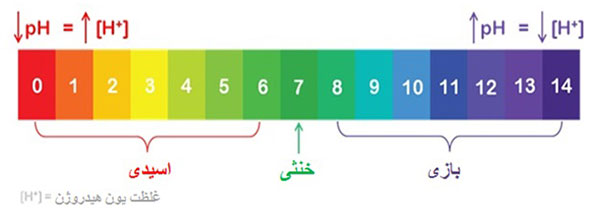
باز چیست؟
در علم شیمی به موادی باز گفته می شود که پذیرنده پروتون باشند. مواد قلیایی در اثر برخورد با اسیدها از خود واکنش نشان می دهند، همه آنها وقتی در آب حل می شوند به شکل یون هیدروکسید در می آیند. این ترکیبات در ساختار خود گروه هیدروکسیل (-OH) دارند و عموما مزه تلخی دارند.
از باز به عنوان قلیا هم نام برده می شود، یعنی به بازهای محلول در آب قلیا می گویند. در واقع بازها غلظت یون هیدرونیوم (+H3O) را در آب کاهش می دهند و در واکنش ها تمایل به گرفتن الکترون دارند.

بازها حالت چرب مانند دارند یعنی محلول بازها می تواند چربی ها را در خود حل کند. بازها باعث تغییر رنگ شناساگرها و خنثی سازی اسیدها می شوند. واکنش بین اسید و باز، خنثی سازی نامیده می شود. در یک واکنش خنثی سازی، یک محلول آبی از یک باز با یک محلول آبی اسیدی واکنش می دهد تا محلول آب و نمک را که در آن نمک به یون های مولکولی آن تفکیک شده باشد، تولید کند. اگر محلول آبی با یک محلول نمکی اشباع شده باشد، هرگونه افزودنی مانند نمک از محلول خارج می شود. اکسید و هیدروکسید فلزات با اسید واکنش می دهند تا آب نمک و نمک ایجاد کنند.
شایان ذکر است که در صورت خنثی سازی اسید با بازهای قوی همچون سود سوزآور یا پتاسیم هیدروکسید، واکنش به شدت گرماده خواهد بود که در این شرایط ماده شیمیایی قلیایی نیز بسیار خطرناک می باشد.
نکته حائز اهمیت این است که هر چه میزان پروتون خواهی قلیا افزایش یابد، میزان قدرت بازی نیز به موازات آن افزایش پیدا می کند. البته شایان ذکر است که قدرت بازی با ثابت تفکیک بازی (pKa) نسبت معکوس دارد، به این معنی که هر چقدر مقدار pKa کمتر باشد، قدرت بازی به همان نسبت بیشتر می شود.
کاتالوگ معرفی مواد شیمیایی فامکو
باز یا همان قلیا تعاریف مختلفی دارد که در زیر به اساسی ترین تعاریف بازها پرداخت شده است:
- باز آرنیوس: طبق نظریه آرنیوس، بازی که در آب حل می شود و گروه هیدروکسید -OH را آزاد کند، باز آرنیوس می نامند.
- باز برونستد: به ماده ای که گیرنده پروتون یا +H است، باز برونستد می گویند.
- باز لوئیس: بر طبق مدل لوئیس، باز به ماده ای گفته می شود که دهنده زوج الکترون است.
ویژگی های عمومی بازها
- بازهای متمرکز و قوی با سموم و مواد آلی و با مواد اسیدی به شدت واکنش نشان می دهند.
- بازهای قوی خورنده هستند.
- دارای طعم تلخ هستند.
- سطح آن ها بسیار لیز و لغزنده است.
- هدایت الکتریکی دارند.
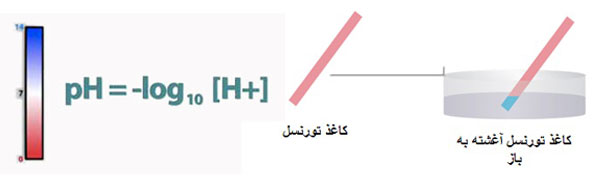
- کاغذ تورنسل را به رنگ آبی درمی آورند.
- فنل فتالئین بی رنگ را به رنگ صورتی تبدیل می کنند.
- همچنین شناساگرهایی مثل کاغذ لیتموس قرمز رنگ را به رنگ آبی و متیل اورانژ (متیل نارنجی) را به رنگ زرد تبدیل می کنند.
- بازها می توانند اکسید، هیدروکسید، و یا کربنات های فلزات باشند.
انواع باز
انواع بازها را می توان بر اساس انرژی، غلظت و اسیدیته دسته بندی کرد:
دسته بندی بازها بر اساس اسیدیته
با تکیه بر تعداد یون های هیدروکسیل (-OH) که با یون های هیدروژن ادغام می شوند، یک باز را می توان به یکی از سه گروه زیر تقسیم بندی کرد:
- باز تک اسیدی یا مونوپروتیک: بازهایی که فقط یک یون هیدروکسیل قابل یونیزاسیون دارند و با یک یون هیدروژن (+H) ترکیب می شوند (فقط پذیرنده یک یون هیدروژن هستند). از نمونه های بازهای مونوپروتیک NaOH و KOH و غیره هستند.
- باز دی اسیدی: بازهایی که در محلول های آبی، دو یون هیدروکسیل آزاد می کنند را باز دی اسیدی یا دی پروتیک می نامند. از جمله بازهای دی پروتیک می توان به هیدروکسید منیزیم، هیدروکسید کلسیم، هیدروکسید باریم، هیدروکسید روی و غیره اشاره کرد.
- باز سه اسیدی یا تری پروتیک: زمانی که یک مولکول از باز بتواند به واسطه یونیزاسیون کامل، سه یون هیدروکسیل آزاد کند، باز سه اسیدی نامیده می شود. به عنوان مثال هیدروکسید آلومینیوم، هیدروکسید آهن و تری هیدروکسید طلا جزو بازهای تری پروتیک می باشند.
دسته بندی انواع بازها بر اساس غلظت
این نوع تقسیم بندی بازها بر اساس غلظت باز در محلول انجام می شود. با این توضیح که در صورتی که غلظت باز در محلول بیشتر باشد، جزو بازهای قوی مثل سود غلیظ محسوب می شود. همچنین در صورتی که غلظت باز در محلول آبی آنها، نسبتا کم باشد، جزو بازهای ضعیف دسته بندی می شود، مثل NaOH رقیق یا KOH رقیق.
دسته بندی انواع بازها بر اساس درجه یونیزاسیون در محلول
این معیار که قدرت بازی نیز نامیده می شود، به تعداد یون های هیدروکسیلی که هنگام حل شدن در آب تولید می شود، بستگی دارد. بر این اساس بازها به دو دسته بازهای قوی و بازهای ضعیف دسته بندی می شوند:
- بازهای قوی: بسته به اینکه مواد بازی چه مقدار یونیزه می شوند و در واقع موادی که در محلول های آبی به صورت کامل یا تا حد زیادی هیدرولیز می شوند، جزو بازهای قوی دسته بندی می شوند.
- بازهای ضعیف: گروهی از انواع بازها هستند که در محلول های آبی به صورت کامل جداسازی نمی شوند یا به تعبیری دیگر فرآیند پروتون دهی در این محلول ها به صورت کامل انجام نمی شود.
چند نمونه از انواع بازها
حالا که با تعریف بازها و ویژگی های فیزیکی و شیمیایی انواع بازها آشنا شدیم، به معرفی چند نمونه از انواع بازها می پردازیم. بازها به صورت کلی به ابربازها، بازهای قوی، بازهای ضعیف، بازهای غیر هیدروکسیدی، باز لوئیس و بازهای جامد تقسیم بندی می شوند.
ابر بازها
چند نمونه از این نوع بازها عبارتند از:
- دی آنیون اروتو/متا-دی اتینیل بنزن
- آنیون لیتیم مونوکسید
- دی آنیون پارا-دی اتینیل بنزن
- آنیون اتیل
- آنیون متیل
- متانیدها
- آنیون وینیل/اتیل
- آنیون هیدرید
- آنیون آمید/آزانید
- آنیون هیدروکسید
همچنین به چند نمونه از بازهای ضعیف نیز اشاره کرده ایم که عبارتند از:
- آنیون فلوئورید
- پتاسیم فرمات
- سدیم هیپوکلریت
- آمونیاک
- آمونیوم هیدروکسید
- متیل آمین
کاربرد باز
بازها یا انواع قلیاها کاربردهای متفاوتی در زمینه های مختلف صنعتی، خانگی و تجاری دارند. به عنوان مثال به چند نمونه و کاربردهای آنها اشاره می شود:
- سدیم هیدروکسید: با فرمول شیمیایی NaOH که با نام سود سوزآور هم شناخته می شود. هیدروکسید سدیم در صنعت صابون سازی، صنایع کاغذ و فیبر مصنوعی مورد استفاده قرار می گیرد.
- هیدروکسید کلسیم: این ماده شیمیایی با فرمول KOH برای تولید سفید کننده ها مورد استفاده قرار می گیرد. همچنین برای زدودن دی اکسید گوگرد خروجی از دودکش نیروگاه ها و کارخانه ها نیز کاربرد دارد.
- منیزیم هیدروکسید: با فرمول شیمیایی MgOH به عنوان یک آنتی اسید و به منظور خنثی سازی اسید اضافی در معده و برای درمان سوء هاضمه کاربرد دارد.
- سدیم کربنات: یکی از بازهای بسیار مهم در صنایع تصفیه آب و فاضلاب بوده و برای از بین بردن عوامل سختی آب مثل کلسیم و منیزیم و به طور کلی نرم کردن آب مورد استفاده قرار می گیرد.
- سدیم هیدروژن کربنات: این قلیا با نام سدیم بی کربنات نیز شناخته شده و برای پخت و پز، ساخت بکینگ پودر و همچنین در کپسول های آتش نشانی نیز کاربرد دارد.
- آمونیوم هیدروکسید: به منظور حذف گریس از لباس استفاده می شود.
اما سایر کاربردهای انواع بازها عبارتند از:
- بازهایی مانند هیدروکسید سدیم یا هیدروکسید پتاسیم به عنوان الکترولیت استفاده می شوند.
- استفاده از آمونیوم هیدروکسید برای از بین بردن لکه های چربی از روی لباس
- در صنایع تولید مواد شوینده به جهت تمیزکاری و سفید کنندگی
- همچنین در ساخت محصولات آرایشی و بهداشتی مثل صابون، خمیردندان، رنگ مو و غیره نیز کاربرد دارد.
- در صنایع کاغذ سازی
- استفاده از بازها اغلب کربنات کلسیم به عنوان آنتی اسید در واکنش با اسید معده برای درمان سوزش سر دل
- استفاده از سدیم بی کربنات (جوش شیرین) در تهیه خمیر نان
- استفاده در کپسول های آتش نشانی
- کاربرد در تولید آفت کش ها














دیـــدگاهها
شما هم درباره این کالا دیدگاه ثبت کنید.
امتیاز: