فروش نشادر یا آمونیوم کلراید
این ترکیب معدنی را در شکل کانی شناسی طبیعی خود سال آمونیاک می نامند. محلول 5 درصد جرمی آمونیوم کلرید در آب دارای pH در محدوده 4.6 تا 6.0 می باشد. همانطور که ذکر شد آمونیوم کلراید یا نشادر در صنایع بسیاری همچون صنایع کود و به عنوان طعم دهنده شیرین بیان کاربرد دارد.

نشادر چیست؟ آمونیوم کلرید را در کشورهایی همچون ایران، تاجیکستان، هند، پاکستان و کشورهای عربی، نشادر می نامند و از آن برای ترد کردن تنقلاتی همچون سمبوسه استفاده می کنند.

مشخصات آمونیوم کلراید
| نام تجاری |
نشادر |
| فرمول شیمیایی |
NH4Cl |
| جرم مولکولی |
53.491 گرم بر مول |
| شکل ظاهری |
جامد بلوری سفید رنگ و بدون بو |
| دانسیته |
1.53 گرم بر سانتی متر مکعب |
| نقطه ذوب |
338 درجه سانتی گراد |
| نقطه جوش |
520 درجه سانتی گراد |
| حلالیت |
محلول در آب و اتانول
کم محلول در استون
نامحلول در دی اتیل اتر و اتیل استات |
ویژگی ها و ساختار لوویس آمونیوم کلرید
آمونیوم کلراید تشکیل شده از اتم های نیتروژن، هیدروژن و کلر ساختاری به شکل زیر دارد:
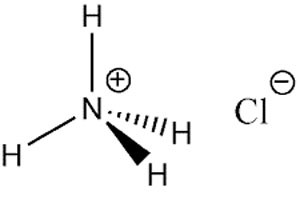
همان طور که گفته شد آمونیوم کلرید خاصیت حل شوندگی بسیار خوبی در آب دارد و همچنین در متانول، الکل، گلیسرول و هیدرازین حل می شود. اما در استون، دی اتیل اتر و اتیل استات نامحلول است. این ترکیب حاصل از سوزاندن زباله های زغال سنگ بوده و از تراکم گاز های مشتق شده از زغال سنگ به دست می آید. کلرور آمونیوم همچنین در اطراف مناطق آتشفشانی نیز مشاهده شده است.
سنتز آمونیوم کلراید
همان طور که اشاره کردیم، این ترکیب شیمیایی به صورت طبیعی در مناطق آتشفشانی وجود دارد و بر روی سنگ های آتشفشانی نزدیک دریچه های آزاد کننده دود (فومارول) تشکیل می شود. کریستال ها به صورت مستقیم از حالت گازی رسوب می کنند، اما عمر کوتاهی دارند، چون به راحتی در آب حل می شوند. اما در زیر به روش صنعتی سنتز آمونیوم کلرید پرداخته ایم.
نمک آمونیوم کلرید به سه روش مختلف زیر سنتز می شود:
- آمونیوم کلرید به عنوان محصول جانبی در طی فرآیند Solvay و به منظور تهیه کربنات سدیم به دست می آید. این روش اصلی ترین و کارامد ترین روش در مقیاس صنعتی و به منظور کاهش انتشار آمونیاک گازی می باشد.
CO2 + 2 NH3 + 2 NaCl + H2O → 2 NH4Cl + Na2CO3
- از واکنش هیدروکلریک اسید یا کلرید هیدروژن گازی با آمونیاک گازی و خالص به دست می آید. لازم به ذکر است به دلیل گرما زا بودن واکنش، به تجهیزات خنک کننده نیاز است.
NH3 + HCl → NH4Cl
- از واکنش بین سولفات آمونیوم و سدیم کلرید، آمونیوم کلرید و سدیم سولفات به دست می آید. در طی این واکنش به دلیل نامحلول بودن سدیم سولفات در آب و تشکیل رسوب، با انجام فرآیند کریستالیزاسیون و خشک کردن آن، می توان آمونیوم کلرید خالص را جداسازی و تهیه کرد.
واکنش های آمونیوم کلرید یا نشادر
این ماده شیمیایی در صورت حرارت دیدن، به آمونیاک و گاز هیدروژن تجزیه می شود که در زیر فرمول آن آمده است:
NH4Cl → NH3 + HCl
در صورت واکنش آمونیوم کلراید با بازهای قوی همچون سدیم هیدروکسید، گاز آمونیاک آزاد می شود که واکنش آن به شکل زیر است:
NH4Cl + NaOH → NH3 + NaCl + H2O
در صورت واکنش آمونیوم کلرید با کربنات های فلزهای قلیایی در دمای بالا، آمونیاک و فلزهای قلیایی تولید می شوند:
2NH4Cl + Na2CO3 → 2NaCl + CO2 + H2O + 2NH3
شایان ذکر است که برخی از واکنش های کلرید آمونیوم با مواد شیمیایی دیگر، واکنشی گرماگیر می باشد. مثلا واکنش نشادر با باریم هیدروکسید در طی حل شدن آن در آب یک فرآیند گرماگیر می باشد.
کاربرد آمونیوم کلرید
آمونیوم کلراید در صنایع مختلف پزشکی، داروسازی، کشاورزی، صنعتی و غیره کاربرد های فراوانی دارد. موارد مصرف آمونیوم کلرید در دو گرید صنعتی و نوع خالص تر آن یعنی نشادر خوراکی عبارتند از:
- استفاده در تولید کود های شیمیایی حاوی ماده نیتروژن همچون کلروآمونیوم فسفات جهت باروری محصولات کشاورزی نظیر برنج و گندم
- در صنعت نساجی و چرم
- در صنایع رنگرزی، چاپ پارچه و خوشه بندی پنبه
- در صنعت الکترونیک برای ساخت مدار های چاپی و حکاکی بر روی آن ها
- در صنایع غذایی به عنوان یک ماده افزودنی همچون مخمر ها در نانوایی
- استفاده در محصولات شوینده و تمیز کننده
- به عنوان عامل ضخیم در سیستم سورفکتانت بر مبنای آمونیوم نظیر شامپو مو
- به منظور حفظ PH ادرار و عامل ادرار آور با عنوان یک نمک اسیدی کننده سیستمیک
- کاربرد به عنوان شار لحیم کاری و قلع کاری به جهت زدودن پوشش اکسید از فلزات و کمک به بهبود چسبندگی لحیم ها
- به عنوان الکترولیت در سلول های خشک مانند باتری های روی - کربن
- کاربرد آمونیوم کلرید در دیفن هیدرامین به عنوان ماده خلط آور و موثر در درمان سرفه
- استفاده در پزشکی به منظور درمان آلکالوز متابولیک شدید
- در آزمایش بارگذاری اسید خوراکی به منظور تشخیص اسیدوز توبولار دیستال کلیوی
- در دامپزشکی به منظور پیشگیری از سنگ ادراری دام ها
- در ترکیب چسب اتصال دهنده تخته های سه لایه
- به عنوان اهدا کننده کلر به جهت افزایش رنگ سبز و آبی از یون های مس در شعله مواد آتش زا و آتش بازی در گذشته
- عامل شناور سازی ماهی های غول پیکر به دلیل چگالی کمتر آمونیوم کلرید موجود در سراسر بدن ماهی ها نسبت به آب دریا
- عامل ایجاد دمای پایین در حمام های خنک کننده در طول تاریخ
- به عنوان اسانس و طعم دهنده برخی از نوشیدنی ها
- استفاده از آمونیوم کلرید در باستان شناسی برای حذف انعکاس روی شیشه و نمونه های مشابه که در عکاسی به کار برده می شوند.
- در سنتز آلی، از محلول اشباع آمونیوم کلراید برای خاموش کردن مخلوط های واکنش استفاده می شود.
- به عنوان یک مکمل خوراکی برای گاو ها و دام ها
- به عنوان افزودنی غذا با کد E510 و به نام سال آمونیاک یا سالمیاک کاربرد دارد که به عنوان ماده مغزی در مخمر ها (در تهیه نان) و بسیاری از میکروارگانیسم ها عمل می کند.
- استفاده در محلول آمونیوم کلراید و آمونیاک و کاربرد آن به عنوان محلول بافر به طور مثال بافر لیز ACK (آمونیوم-کلرید-پتاسیم)
- استفاده از محلول آبی 5 درصدی آمونیوم کلراید در صنایع نفت و برای حفاری چاه
- به منظور تولید دود سفید رنگ
- برای محکم کردن برف پیست های اسکی و جلوگیری از آب شدن برف در دمای بالای صفر درجه
- در کشاورزی کارایی بیشتر آمونیوم کلراید نسبت به آمونیوم سولفات به دلیل هزینه کمتر و غلظت بالاتر و همچنین افزایش جذب کادمیم به دلیل افزایش کلر در خاک
- در صنعت آبکاری به عنوان تمیز کننده سطوح و به منظور جاذب رطوبت از سطح فلزات و افزایش کیفیت آبکاری آن ها
نکات ضروری استفاده از آمونیوم کلراید در کشاورزی
ذکر این نکته حائز اهمیت است که به دلیل خاصیت اسیدی آمونیوم کلراید، استفاده از آن به عنوان کود فقط برای خاک هایی که شور یا قلیایی هستند مجاز بوده و فراموش کردن این نکته و استفاده نامناسب از آن می تواند به خاک آسیب رسانده، موجب اسیدی شدن آن و از بین رفتن محصولات زراعی شود.
MSDS آمونیوم کلرید
- در صورت تماس آمونیوم کلرید با پوست و چشم ها ممکن است موجب سوزش شدید شود، سریعا محل آلوده شده را حداقل به مدت 15 دقیقه با آب فراوان بشویید.
- در صورتی که کلرید آمونیوم به اشتباه خورده شد بلافاصله آب فراوان بنوشید و خود را وادار به استفراغ نکنید و نهایتا به پزشک مراجعه کنید.
- در صورت استنشاق ممکن است موجب سرفه و تنگی نفس بشود، در این صورت هر چه سریعتر به محیط آزاد بروید و نفس بکشید.
- به منظور جلوگیری از هر گونه خطرات احتمالی هنگام کار با كلريد آمونیوم حتما از تجهیزات ایمنی نظیر دستکش، عینک و روپوش آزمایشگاه استفاده کنید.
- در صورت بروز هر یک از اتفاقات ذکر شده فورا به پزشک اورژانس مراجعه کنید.
- همچنین هنگام استفاده از گرید خوراکی آمونیوم کلرید، بیماران باید از نظر علائم سمیت با آمونیاک نظیر آریتمی قلبی، تنفس نامنظم، تعریق، رنگ پریدگی و غیره تحت نظر باشند.
- مصرف نمک آمونیوم کلرید در بیمارانی که دچار نارسایی کبدی و کلیوی هستند ممنوع می باشد.
تاریخچه آمونیوم کلرید یا نشادر
آمونیوم کلراید برای اولین بار در سال 554 پس از میلاد در چین کشف شد. منابع این ترکیب معدنی عبارت بودند از:
- منافذ آتش سوزی زیرزمینی زغال سنگ در آسیای مرکزی به ویژه کوه های تیان شان
- فومارول های آتشفشان کوه تفتان در جنوب شرقی ایران
در حدود 800 سال پس از میلاد، اعراب مصر کلرید آمونیوم را در دوده حاصل از سوزاندن سرگین شتر کشف کردند که این موجب شد تا منبع جایگزینی برای منابع آسیای مرکزی باشد.
کلیه قیمت ها بدون اطلاع قبلی قابل تغییر می باشد، لطفا جهت استعلام قیمت خرید با واحد فروش تماس حاصل نمایید.
تاریخ بروزرسانی: 1401/01/29
قیمت آمونیوم کلرید
| ردیف |
شرح |
قیمت به تومان |
| 1 |
قیمت آمونیوم کلرید (هر کیلوگرم) |
14,400 |















دیـــدگاهها
شما هم درباره این کالا دیدگاه ثبت کنید.
امتیاز: