هیدروسولفیت سدیم چیست؟
جامدی کریستالی با رنگ سفید تا زرد روشن که نوعی نمک محلول در آب می باشد این ترکیب همچنین توانایی حل شدن در الکل هاو اتر ها رانیز دارا می باشد دارای فرمول شیمیایی NaHS بوده و یک ماده بسیار کارآمد در بخش تولید کاغذ و نساجی می باشد.هیدرو سولفیت سدیم همچنین با نام سدیم دی تیونیت نیز شناخته می شود. اگر شما هم قصد خرید هیدروسولفیت سدیم را دارید اولین قدم آشنایی با این ماده است، برای آشنایی با هیدروسولفیت سدیم و شناخت آن با توجه به نوع کاربری به صفحه هایپر صنعت فامکو مراجعه نمایید.
این مقاله درباره هیدروسولفیت سدیم بوده که می تواند به آشنایی بیشتر شما از این ترکیب کمک کند در واقع این بخش به معرفی هیدرو سولفیت سدیم و مشخصات فنی آن می پردازد همچنین فرایند تولید آن و کاربردهایی که می تواند در صنعت داشته باشد مورد بررسی قرار می گیرد.
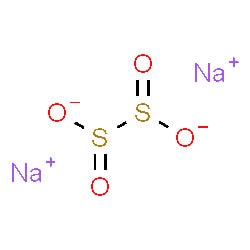
معرفی هیدروسولفیت سدیم
جامدی کریستالی با رنگ سفید تا زرد روشن که نوعی نمک محلول در آب می باشد این ترکیب همچنین توانایی حل شدن در الکل ها و اتر ها را نیز دارا می باشد دارای فرمول شیمیایی NaHS بوده و یک ماده بسیار کارآمد در بخش تولید کاغذ و نساجی می باشد. هیدرو سولفیت سدیم همچنین با نام سدیم دی تیونیت نیز شناخته می شود.
این ترکیب در حالتی که در تماس با هوا نباشد پایدار بوده ولی در آب داغ و محلول اسیدی به سرعت تجزیه می شود.این ماده در صورت تماس با رطوبت و آب خود به خود گرم می شود.
خواص فیزیکی و شیمیایی هیدرو سدیم سولفیت
این ترکیب دارای قدرت کاهندگی بالایی می باشد که باعث شده است در بسیاری از واکنش های شیمیایی به عنوان عامل کاهنده استفاده شود.این ماده در تماس با رطوبت و آب تولید گرما می کند دارای نقطه ذوب 17.22 درجه سانتیگراد در حالت خشک وبدون آب آن است و در دمای 100 درجه سانتیگراد به جوش می آید دارای جرم مولکولی 56.063 gr/mol و دانسیته 1.79 می باشد. از نظر پایداری این ماده درمحیط تا وقتی که در تماس با هوا نباشد پایدار بوده ولی در صورت تماس با رطوبت و هوا تجزیه می شود.
فرایند تولید هیدرو سدیم سولفیت
برای تولید هیدرو سدیم سولفید دو روش وجود دارد:
روش اول
کاهش سدیم بی سولفیت توسط گرد روی در حضور اسید سولفوریک است. مطابق با واکنش زیر:
2NaHSO3 + H2SO3 + Zn => ZnSO3 + Na2S2O4 + 2H2O
محصول تولید شده از این واکنش را با آب آهک وارد واکنش می کنند تا مقدار اسید آزاد که وارد واکنش نشده است خنثی شود که در این فرایند انحلال پذیری ZnSO3 کاهش می یابد و با کاغذ صافی جدا می شود. جهت جداسازی Na2S2O4.2H2O نیز از سدیم کارید استفاده می شود پس از جداسازی با الکل آبگیری و خشک می شود.
روش دوم
تعلیقی آبی از گرد روی در فرمالدهید با گوگرد دی اکسید در دمای 80 درجه سانتیگراد واکنش می دهند. این واکنش تجزیه در مجاورت نمک قلیایی دو بار انجام می شود و نمک سدیم به دست می آید. محصول خالص آن نیز از طریق تبخیر در خلا حاصل می شود.
روش های دیگری نیز برای تولید هیدرو سدیم سولفیت موجود است که می توان به کاهش محلول سدیم سولفیت با ملغمه سدیم که در تهیه کلر با استفاده از پیل جیوه ای در ph در محدوده 5 تا 7 تشکیل می شود است. همچنین می توان از سدیم فرمات هیدرو سدیم سولفیت تهیه کرد.برای این کار سدیم فرمات با گوگرد دی اکسید و سدیم هیدروکسید واکنش می دهد:
HCOONa + 2SO2 + NaOH => Na2S2O4 + CO2 + H2O
کاربردهای هیدرو سدیم سولفیت
کاربرد عمده این ماده در صنعت نساجی و چاپ می باشد جایی که به عنوان یک عامل کاهنده خیلی قوی در جدا کردن برخی از رنگینه ها از پارچه و صابون ها کاربرد خوبی دارد.
- این ترکیب در صنعت چوب وکاغذ بهعنوان سفید کننده خمیر کاغذ و چوب استفاده می شود.
- به عنوان بی رنگ کننده در در صنایع خشکبار و قندو شکر
- استخراج مس
- صنعت آرایشی به عنوان ماده شیمیایی گوگردی
- صنعت چرم برای از بین بردن موهای پوست
- صنعت داروسازی
نتیجه گیری
هیدرو سولفیت سدیم به عنوان یک عامل کاهنده قوی کمک خوبی به صنعت نساجی جهت حذف رنگ های اضافی از پارچه و صابون ها داشته است اما هزینه های تولید این ماده بسیار بالا می باشد که باعث شده است سود آوری آن پایین باشد.